有機化學的基礎362
From New Year's Concert, conducted by Zubin Mehta
1. 甲苯比苯600倍地容易進行親電性芳香溴化反應,因為甲苯的甲基原子團,比苯的氫原子更能夠穩定過渡狀態與芳基陽離子。
2. 方位Orientation。甲苯進行親電性溴化反應製造出來的產物大多是對-溴-甲苯para-bromo-toluene,而不是統計上的三種位置的苯取代基產物皆有。
3. 如果反應沒有其他因素影響,光從甲苯可以連接溴的位置來考量,五個碳中,有2個碳在甲基鄰近的位置可提供溴鍵結-鄰ortho,2個碳在與甲基間隔一個碳的位置提供溴鍵結-間meta,1個碳在甲基對面的碳的位置提供溴鍵結-對para;
4. 因此理論上溴化甲烷三種取代位置鄰ortho、間meta、對para的比例是2:2:1。但是實際上的實驗結果不是如此,甲苯親電性溴化反應的產物是,溴取代基在鄰ortho與對para的產物比例遠高過在間meta的位置(高於預測值)。
5. 親電性溴化反應進行的方式與親電性氯化反應一樣,如下圖:
6. 溴分子和路易斯酸(在這裡是FeBr3)錯合物製造出活性親電性試劑,將一當量的溴陽離子Br+加掛到芳香環上。
7. 「甲苯」被「溴」這個親電性試劑攻擊,產生三種產物:一是甲基與溴彼此相對位置是鄰ortho,二是甲基與溴彼此相對位置是間meta,三是甲基與溴彼此相對位置是對para。每種反應的過程都會產生碳陽離子,碳陽離子透過共振保持穩定。
8. 親電性試劑溴離子Br+攻擊甲苯「鄰ortho」與「對para」的位置後產生的碳陽離子中間產物共有三種共振結構,其中一種共振結構在甲基取代基的位置帶正電荷。
9. 因為烷取代基能夠穩定碳陽離子,因此正電荷在與甲基鍵結的碳上的位置通常比較穩定。
10. 由於親電性試劑在苯的「鄰ortho」與「對para」的位置進行攻擊產生的碳陽離子,其三種共振結構中有一個是特別穩定的結構,這會提高碳陽離子的整體穩定性,有利於反應在速度決定步驟順利製造出碳陽離子。接著碳陽離子去質子化(脫去1個質子H+),製造出取代產物。
11. 當親電性試劑攻擊的位置是,與甲苯的甲基間隔一個碳的位置meta,製造出來的碳陽離子中沒有任何比較穩定的共振結構。
12. 甲苯進行親電性取代反應的產物傾向於生成二個取代基位置是鄰ortho或對para,這個現象背後的原因是甲基釋放電子給帶正電荷的碳,穩定了碳陽離子中間產物。
13. 因此,甲苯進行親電性取代反應製造出二取代基在鄰ortho或對para的位置的產物,過程要跨越的過渡狀態,其能量較低。
14. 如果甲基供給電子的影響這麼大,應該會有三分之二的產物二個取代基的位置是相鄰的ortho-substituted,三分之一的產物二個取代基的位置是相對的para-substituted。
15. 徐弘毅注:這句話的意思是,如果甲苯進行親電性取代反應的結果是產生二取代基在相鄰的ortho位置的產物,那麼,親電性試劑可以攻擊「連接甲基的碳」的「左邊的碳」或「右邊的碳」,有二個位置的機會;
如果甲苯進行親電性取代反應的結果是產生二個取代基在相對para的位置,那麼親電性試劑只能攻擊「連接甲基的碳」其「對面的碳」,只有一個攻擊位置的機會。
因此光從攻擊位置來看,應該會有三分之二的產物二個取代基的位置是相鄰的ortho-substituted,三分之一的產物二個取代基的位置是相對的para-substituted。
16. 可是事實上,二個取代基的位置是相對的para的產物比例大於預期,可見得還有其他的因素阻止二個取代基的位置是相鄰的ortho產物形成。到底是什麼原因呢?
17. 最可能的答案是,苯的烷基側鍊,使親電性試劑攻擊苯甲基對面碳ortho次數密度高於苯甲基相鄰的碳para。(甲基對面的碳是一大片開放空間,比較沒有阻礙)
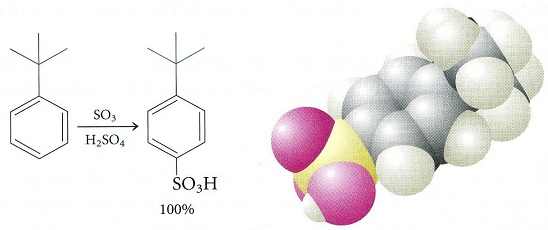
18. 舉例來說,第三丁基苯t-butylbenezen 親電性磺酸化反應產生二個取代基彼此位置是相對para的產物,因為龐大的烷基阻擋親電性試劑攻擊緊鄰ortho烷基的碳。
19. 因此,電子(烷基穩定正電荷)的因素有利於親電性試劑對苯的鄰ortho與對para的位置攻擊,而立體阻礙則有利於對para的取代反應。
20. 活性Activation。甲苯的甲基,不僅控制了反應的區域選擇化學,引導親電性試劑攻擊甲苯鄰ortho與對para的位置,也加速反應的進行速率。
21. 甲苯溴化反應速度比苯溴化反應快,因為甲基能夠穩定過渡狀態,讓過渡狀態分子順利變成中間產物碳陽離子;甲苯的甲基穩定過渡狀態分子的能力高於苯的氫原子。
22. 甲苯的親電性取代反應產生鄰ortho與對para產物,這是因為親電性試劑攻擊的位置是甲基相鄰ortho的碳或甲基對面para的碳,而不是間隔一個碳meta時,形成的過渡狀態分子與中間產物比較穩定。
23. 衡量反應物質活性大小的方法是,將「有取代基的苯」與「沒有取代基的苯」加以比較出來的結果;衡量取代基攻擊的位置對反應結果影響的方法是,比較親電性試劑對「有取代基的苯」的鄰、間、對三種位置攻擊產生中間產物何者比較穩定。
24. 用另一個角度來看,去活性的原子團(鹵素),也是產生「鄰-對ortho-para位置」取代反應的原因;因為這些去活性的原子團對「鄰-對ortho-para位置」中間產物穩定度的破壞性,低於它們攻擊間meta的位置產生的中間產物。
25. 鹵素是去活性的原子團,鹵素與「有取代基的苯」進行的取代反應時,會攻擊「有取代基的苯」的鄰ortho、對para位置。
26. 換一個角度來看,一切有活性的原子團也會遵守鄰ortho、對para位置的法則。(因為活性原子團攻擊「有取代基的苯」的鄰ortho、對para位置比較能提高中間產物的穩定度)。
27. 烷基的活化天性在Friedel-Crafts烷化反應製造了一些問題:產物比初始反應物更容易起反應。因此,混合一當量的苯與鹵烷,再加上AlCl3,就會產生mono-單取代基、di-雙取代基、tri -三取代基的產物。
28. 烷基的活性造成Friedel-Crafts烷化反應不可避免的結果就是產生多烷基化的產物(例如,連接很多烷基的苯)。然而這個問題僅止於烷化反應。其他的親電性芳香取代反應的取代基是去活性的,能避免芳香環在取代反應後,繼續更進一步地進行反應。
n 翻譯編寫 Marye Anne Fox, James K. Whitesell《Organic Chemistry》




沒有留言:
張貼留言