有機化學的基礎364
1. 醯胺與酯能扮演電子提供者的角色引導親電性試劑攻擊鄰ortho與對para的位置,不過,醯胺與酯在活化親電性芳香取代反應方面屬於中等的活化劑。
2. 這是因為與芳香環鍵結的異質原子,它的一對未鍵結電子不時移動到羰基來回共振,因此與芳香環鍵結的異質原子要提供電子給芳香環是比較困難的。
3. 舉例來說,乙酸苯酯phenyl acetate和乙醯苯胺N-phenylacetamide的共振結構,使氧和氮上的一對未鍵結電子供應給芳基陽離子的能力下降。
4. 許多親電性芳香取代反應(芳香化合物的親電性取代反應),傾向於使用醯胺與酯這類芳基衍生物,而不是直接使用酚或苯胺,酚的氫氧基和苯胺的胺基活性太強,會讓取代反應變得很難控制。
5. 烷基原子團與芳香環鍵結的那顆原子(碳)缺乏未鍵結的電子,因此穩定碳陽離子中間產物的能力略遜於醯胺或酯原子團。烷基原子團無法像強烈或中性的異質原子團那樣,透過釋放π電子穩定過渡狀態。
中度去活性取代基:鹵素 Moderately Deactivating Substituents:The Halogens
6. 鹵素是中度去活性的取代基,氯苯進行硝化反應的速度比苯進行硝化反應慢了五十倍,足以證明鹵素(氟、氯、溴、碘)具有去活性的性質:
7. 雖然鹵素是中性的去活性劑,它們確實引導鄰ortho、對para取代反應,就像其他擁有未鍵結電子對的取代基(活化基)一樣。
8. 鹵素與親電性試劑進行取代反應產生的鄰ortho與對para中間產物,比間meta中間產物更穩定,因為當取代基攻擊芳香環的位置是鹵素ortho鄰接的碳與para對面的碳時,鹵素的未鍵結電子對可以與芳香環上的π電子共軛,這點跟芳香環上的氧與氮取代基(活化基)一樣。
9. 不過鹵素取代基的未鍵結電子對與芳香環上的π電子交互作用的力量,比第二列元素取代基與芳香環上的π電子交互作用的力量作用小,舉例來說,氧與氮就屬於第二列元素,它們與芳香環上的π電子交互作用的力量較大。
10. 芳香鹵化物的鹵原子有三對未鍵結的電子,但是要提供鹵素的電子雲給芳基陽離子中間產物作為穩定之用,必須讓鹵素的電子與芳基陽離子之碳的第二能階p軌域交疊;困難之處在於,鹵素當中有許多元素是大於第二能階的,氯Cl的未鍵結電子在第三能階,溴Br的未鍵結電子在第四能階,碘I的未鍵結電子在第五能階。
11. 因為軌域之間的交疊不足以彌補鹵素與生具有的陰電性對電子的需求,因此它們是中度的去活性基,鹵素能夠提供給芳基陽離子穩定之用的電子雲較少,比不上芳基陽離子本身所連接的氫原子所提供的電子雲量。
12. 雖然氟跟碳一樣是第二能階的元素,它的未鍵結電子所處的軌域跟碳差不多,可是氟的高陰電性阻止氟提供提供電子。(再複習一次,所有鹵素的陰電性都強於氫)
13. 鹵素與親電性試劑進行取代反應產生的中間產物陽離子,如果它的鹵素與親電性試劑的關係是間隔meta一個碳原子,那麼,芳香環上鹵素的主要功能就是透過σ鍵將電子雲拉向自己(鹵素拉電子的能力勝於氫原子)。
14. 鹵素與親電性試劑進行取代反應產生的中間產物陽離子,如果它的鹵素與親電性試劑的關係是鄰ortho與對para,鹵素對電子的拉力被芳香環上的π電子抵銷掉一些。
15. 徐弘毅注:如果中間產物碳陽離子的鹵素與親電性試劑的關係是間隔meta一個碳原子,在三種共振結構中,其中二個共振結構的正電荷位於與鹵素連接的碳隔壁的碳原子上,當鹵素拉電子的時候,無法從帶正電荷的碳原子上拉到負電子,只能從另一側拉電子,這會有什麼後果?
鹵素傾盡全力直接從芳香環的其中一條路徑拉π電子,將造成還不太穩定的親電性試劑與芳香環的碳之間的共價電子被扯斷脫離,這使得反應又回到原點,恢復成反應物鹵苯的狀態,因此親電性試劑攻擊鹵苯間meta的位置是不容易成功的。
16. 因此芳基鹵化物的對para與鄰ortho中間產物比間meta中間產物穩定,但是比由苯變成的芳基陽離子不穩定。
17. 因為鹵素是去活性的取代基,鍵結一個鹵素的芳香環取代反應後的產物比初始物質(反應物)不容易起反應,因此可以透過調整控制親電性試劑與載體的比例,防止取代反應完成後,產物繼續進行其他反應。
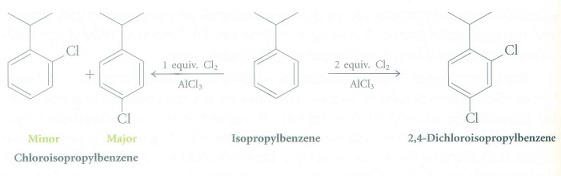
18. 舉例來說,如果要使異丙苯單鹵化monochlorination,需使用1當量的Cl2。如果要讓異丙苯雙鹵化dichlorination,需使用2當量的Cl2。
n 翻譯編寫 Marye Anne Fox, James K. Whitesell《Organic Chemistry》



沒有留言:
張貼留言