化學原理啟迪431
"Dolce e Gabbana" Spring Summer 2013 Milan full show
Pret a Porter Woman
1.
溶質溶解於溶劑調製而成的溶液,其凝固點低於純溶劑的凝固點,為什麼?
2.
再複習一次,在0℃下,「純水結成的冰」和「純水」的蒸汽壓一樣。溶質溶解於溶劑水,調製而成的溶液,其凝固點不會在0℃,因為「溶液內的水」的蒸汽壓,低於「純水的冰」的蒸氣壓;意思是,在0℃溶液不會結冰。
3.
徐弘毅注:凝固點就是物質的液態與固態可同時存在的溫度點,這個時候液體的蒸汽壓與固態冰的蒸汽壓一樣,所以液體不會完全結凍成固體,而固體也不會完全融化成液體;
純水的凝固點是0℃,在0℃液態純水與固態冰(純水結凍)的蒸汽壓一樣,兩相(固態、液態)平衡。
可是溶液卻不是這樣,0℃時,「溶液內的水」的蒸汽壓,低於「純水的冰」的蒸氣壓,這代表0℃剛結凍的冰,很快地變回液態水,所以溶液在0℃是呈現液態。
4.
不過,因為溫度下降過程,冰的蒸汽壓下降得速度,比液態水快。因此,只要溶液拿去冷凍降溫,最後一定會達到冰的蒸汽壓與液態水的蒸汽壓一樣;最終的結果是,溶液的凝結點低於0℃,凝固點下降了。
5.
我們可用簡單的模型說明冰與水的行為,圖左為冰在純水溶液內的溶解情形,圖右為冰在含有溶質的溶液內溶解的情形:
6.
溶液裡的溶質,會降低液態水分子,回復成固態冰的速率。這種含有溶質的溶液,在0℃仍是液態的。溶液在降溫時,水分子離開固態冰的融化速率下降(因為溶質會擋住冰塊內的水分子脫離)。
7.
讓溫度持續下降,直到溶液裡冰的融化速率,與水凝結成冰的速率一致,達到平衡,才是達到此溶液的凝固點。
8.
因為溶質會降低水的凝固點,所以寒冷氣候地區的人會用氯化鈉和氯化鈣潑灑在街道、人行道上,以防止結冰。當然,如果溫度太冷,低於鹽水溶液的凝固點,還是會變成冰,所以,在極度寒冷的氣溫下,這招是沒用的。
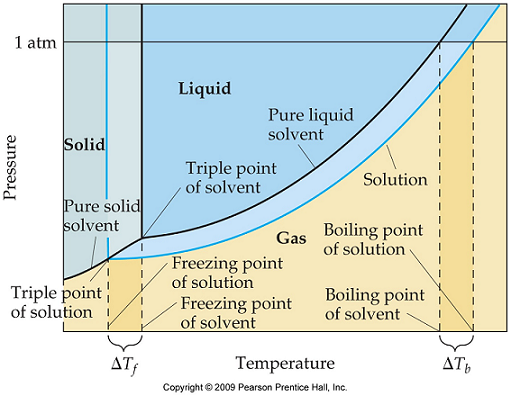
9.
圖為含有溶質的溶液的固態/液態分界線。因為溶質能提高溶劑的沸點,降低溶劑的凝固點。添加溶質可以擴大溶劑維持液態的溫度範圍。
10.
溶液凝固點下降的方程式:
ΔT=Kf msolute
ΔT是凝固點的溫度下降幅度,或純溶劑凝固點與溶液凝固點之間的差距。Kf是特定溶劑的常數,稱為凝固點下降常數modal freezing-point depression constant。
11.
常見的幾種溶劑的下降常數Kf如下:
12.
【例題】乙二醇C2H6O2是防凍劑的主要成分,汽車散熱器裡若有10.0L的水,要加多少防凍劑,才能調製出凝固點為-10.0°F(-23.3℃)的溶液?假設水的密度是1g/ml。
13.
【解題】散熱器內的水,調製之後,溫度從0℃降到-23.3℃。我們利用凝固點下降方程式,判斷出需要多少乙二醇才能達到目標。
ΔT=Kf msolute
在此,ΔT=23.3℃,Kf=1.86
℃kg/mol
解開重量莫耳濃度
msolute=ΔT
/ Kf=23.3℃/1.86
℃kg/mol=12.5
mol/ kg
意思是,每公斤kg的水要添加12.5mol的乙二醇。我們已經有10.0L/10.0kg的水(水的密度1g/ml,所以10.0L的水等於10.0L×1g/ml=10.0×1kg/1L=10.0kg),因此我們總共需要的乙二醇莫耳數:
12.5mol/kg
× 10.0kg=1.25×102mol
1.25×102mol乙二醇的重量是
1.25×102mol×62.1g/mol=7.76×103g(或7.76kg)
註:C2H6O2的莫耳量=12×2+6+16×2=24+6+32=62
g/mol
14.
如同沸點升高方程式,凝固點下降方程式能用來判斷溶質的莫耳量和溶液的性質。
n 翻譯編寫Steven S. Zumdahl 《Chemical Principles》;圖片來源/Tarleton.edu、textbook.s-anand.net、wps.pearsoncustom.com、scienceiscool.org


沒有留言:
張貼留言