化學原理啟迪327
1. 原子的第三種電子軌域稱為d 軌域,當主量子數(能階)n=1或n=2時,沒有d 軌域;d 軌域從能階n=3(角動量子數l=2)開始出現。五種3d 軌域的外型如下:
2. 五種d 軌域,基本上可依據造型的共通性分為二大類。其中四種d 軌域(dxz、dyz、dxy和dx2-y2)是從一個中心點展開的四瓣圓球型軌域,這四瓣圓球型軌域都在同一個平面上。
Schubert - Piano Sonata in C minor, D. 958 I. Allegro
3. 特別留意,dxy 和dx2-y2都在xy平面,dx2-y2的球型軌域在x軸和y軸上,但dxy的球型軌域則位於 x 軸與 y 軸之間。
4. 第五種軌域 dz2 的造型比較特殊,有二瓣球型軌域沿著 z 軸,還有一個位於 xy 平面上的環狀軌域,像腰帶一樣綁著 z 軸上的軌域。
5. 描述電子在 d 軌域波狀運動的函數的正負號,寫在d軌域的不同區域上。原子的電子的能階大於3之後所形成的其他 d 軌域,外型與 3d 軌域很像,只是每一瓣的球型軌域體積變大。
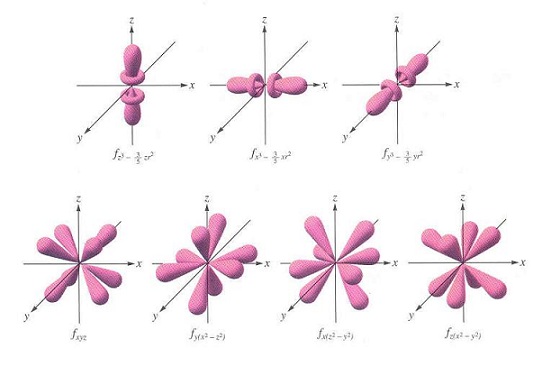
6. 當原子的電子的能階等於4:n=4會出現 f 軌域, f 軌域的外型比 d 軌域更複雜。下圖顯示 4f 軌域(角動量子數 l=3)與每一種 4f 軌域所對應的座標:
7. 以上各種 f 軌域的外型,不是因為鍵結而造成的。因為 f 軌域比較複雜,因此 f 軌域函數所描述的波狀運動的相(正、負號)沒有辦法寫出來。
8. 到目前為止,我們談過氫原子的電子軌域的造型,但是還沒有談到它們的能量。氫原子的電子在某特定軌域的能量決定於能階/主量子數n。因此在同一個能階下的所有軌域,其能量都是一樣的,稱為degenerate。下圖是氫原子的前三個量子能階的軌域:
9. 氫原子唯一的一顆電子可以隨著原子系統的能量變化,到任何一個能階軌域中。
10. 如果沒有灌注任何能量,氫原子的電子會處於最低能量狀態,稱為「基態ground state」,也就是電子會在1s軌域內活動。如果外界灌注能量到原子中,氫原子的電子會轉移到高能量軌域,進入到「激態excited state」。
11. 摘要 氫原子的量子力學
在量子力學模型中氫原子的電子是波,它是以波的模式移動前進的。依據量子力學模型,科學家導出一系列氫原子的電子的波函數,波函數描述氫原子的電子各種情況下的能量(能階)與在空間中的分佈(軌域)。
依據海森堡不確定原理,氫原子的電子模型不可能掌握電子運動的細節。因此,波函數的平方描述的是電子在軌域內運動的可能分佈範圍。我們利用電子可能的分佈區域或電子密度地圖描繪出電子軌域。
軌域的大小範圍是原子表面涵蓋90%電子總量的地方。
氫原子有許多種軌域。在基態氫原子的唯一一顆電子在1s 軌域。當氫原子吸收外界能量時,氫原子的電子會被激化跑到高能階軌域。


沒有留言:
張貼留言